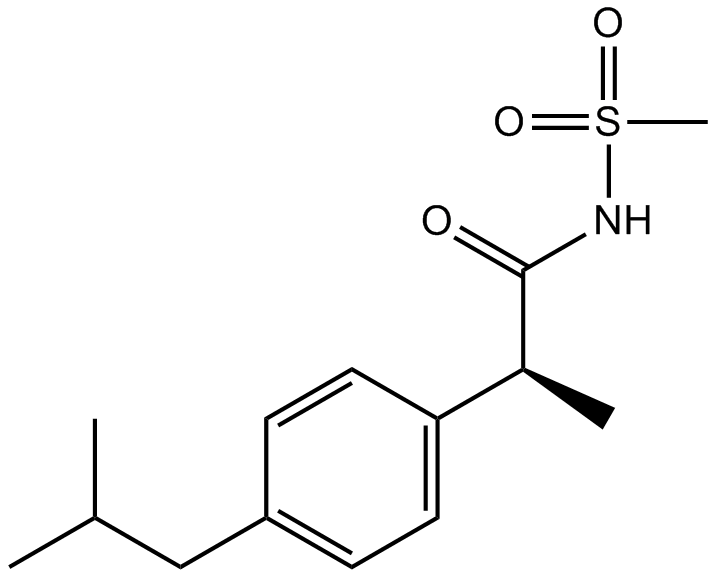
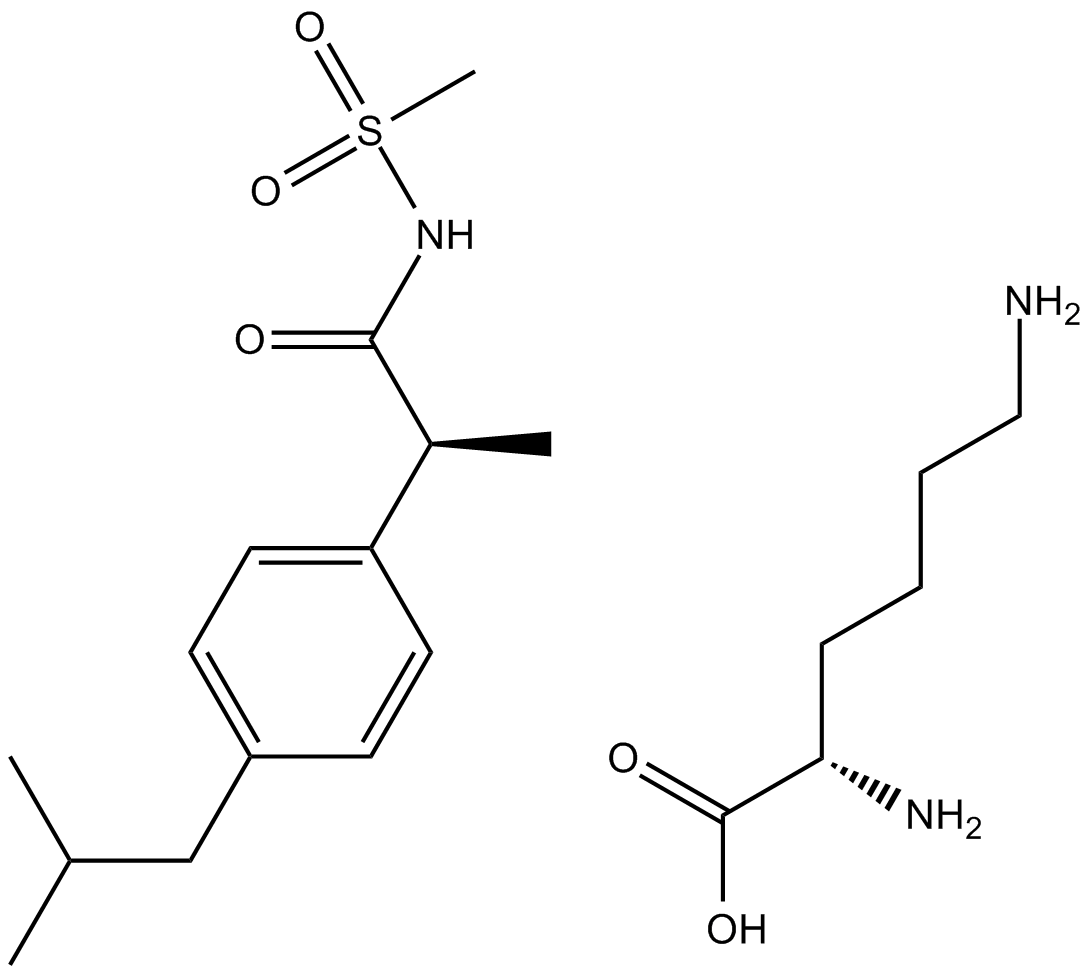
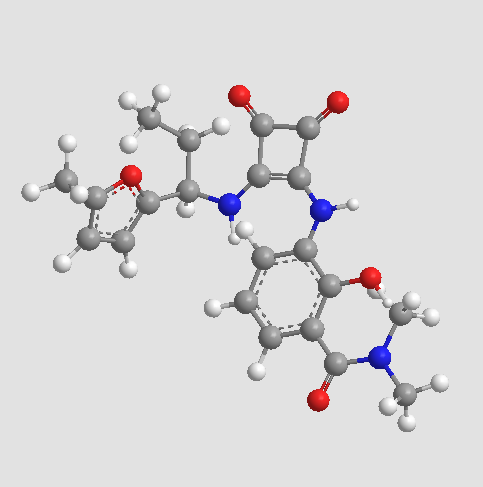
Plerixafor (AMD3100)
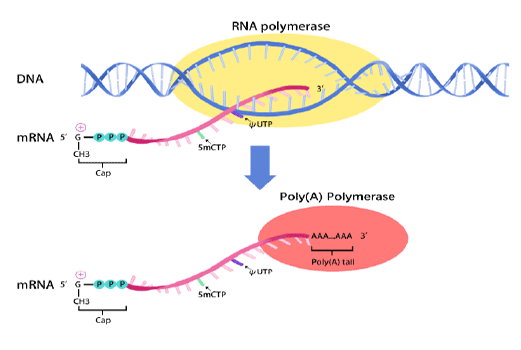
mRNA synthesis
In vitro transcription of capped mRNA with modified nucleotides and Poly(A) tail
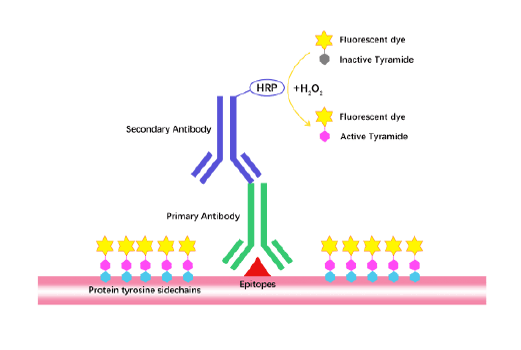
Tyramide Signal Amplification (TSA)
TSA (Tyramide Signal Amplification), used for signal amplification of ISH, IHC and IC etc.
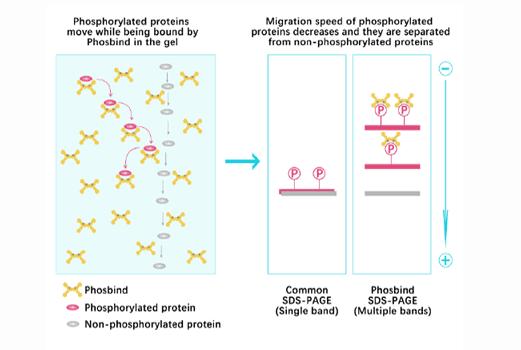
Phos Binding Reagent Acrylamide
Separation of phosphorylated and non-phosphorylated proteins without phospho-specific antibody
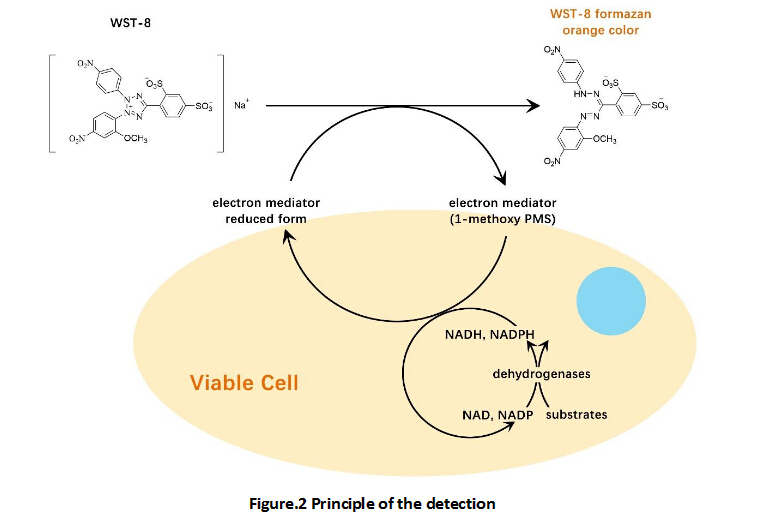
Cell Counting Kit-8 (CCK-8)
A convenient and sensitive way for cell proliferation assay and cytotoxicity assay
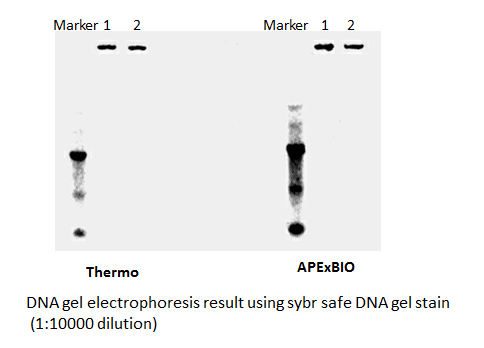
SYBR Safe DNA Gel Stain
Safe and sensitive stain for visualization of DNA or RNA in agarose or acrylamide gels.
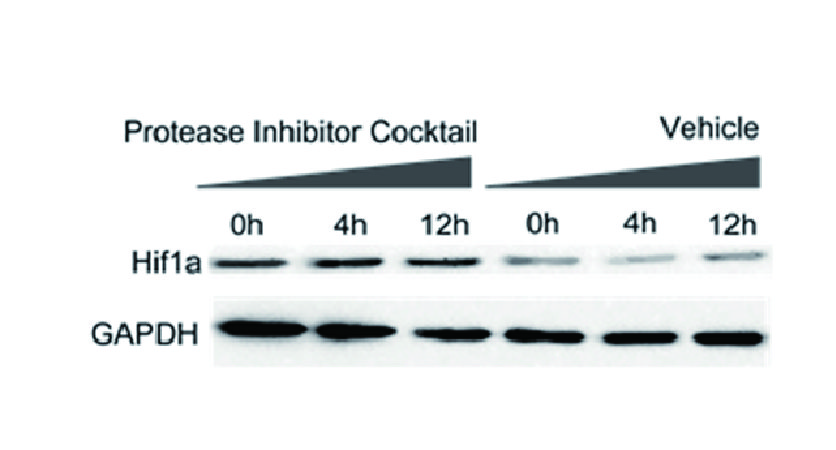
Inhibitor Cocktails
Protect the integrity of proteins from multiple proteases and phosphatases for different applications.
Plerixafor(AMD3100)是CXCR4以及CXCL12介导的趋化性的小分子抑制剂,IC50值分别为44 nM和5.7 nM [1]。
CXCR4和SDF-1是调节肿瘤细胞浸润和转移过程中的关键因素,Plerixafor可以防止SDF-1结合CXCR4从而抑制癌症转移[2]。Plerixafor干扰CXCL12/CXCR4介导的骨髓造血干细胞在骨髓中的保留,导致它们在血液中的运动[3]。Plerixafor扩大肺中循环性中性粒细胞的释放,同时防止中性粒细胞回到骨髓[4]。三个WHIM综合症的成年人连续6个月每天两次皮下注射0.01至0.02毫克/千克的Plerixafor,他们的循环白细胞不断增加,相关的感染更少[5]。
参考文献:
[1]Zabel BA, Wang Y, Lewén S, Berahovich RD, Penfold ME, Zhang P, Powers J, Summers BC, Miao Z, Zhao B, Jalili A, Janowska-Wieczorek A, Jaen JC, Schall TJ. Elucidation of CXCR7-mediated signaling events and inhibition of CXCR4-mediated tumor cell transendothelial migration by CXCR7 ligands. J Immunol. 2009 Sep 1;183(5):3204-11.
[2].Li J, Oupicky D. Effect of biodegradability on CXCR4 antagonism, transfection efficacy and antimetastatic activity of polymeric Plerixafor.Biomaterials. 2014 Jul;35(21):5572-9.
[3]. Broxmeyer HE. Chemokines in hematopoiesis. Curr Opin Hematol. 2008 Jan;15(1):49-58.
[4]. Devi S, Wang Y, Chew WK, Lima R, A-González N, Mattar CN, Chong SZ, Schlitzer A, Bakocevic N, Chew S, Keeble JL, Goh CC, Li JL, Evrard M, Malleret B, Larbi A, Renia L, Haniffa M, Tan SM, Chan JK, Balabanian K, Nagasawa T, Bachelerie F, Hidalgo A, Ginhoux F, Kubes P, Ng LG. Neutrophil mobilization via plerixafor-mediated CXCR4 inhibition arises from lung demargination and blockade of neutrophil homing to the bone marrow. J Exp Med. 2013 Oct 21;210(11):2321-36.
[5]. McDermott DH, Liu Q, Velez D, Lopez L, Anaya-O'Brien S, Ulrick J, Kwatemaa N, Starling J, Fleisher TA, Priel DA, Merideth MA, Giuntoli RL, Evbuomwan MO, Littel P, Marquesen MM, Hilligoss D, DeCastro R, Grimes GJ, Hwang ST, Pittaluga S, Calvo KR, Stratton P, Cowen EW, Kuhns DB, Malech HL, Murphy PM. A phase 1 clinical trial of long-term, low-dose treatment of WHIM syndrome with the CXCR4 antagonist plerixafor. Blood. 2014 Apr 10;123(15):2308-16.
- 1. Shuang Zou, Dongchen Zhang, et al. "JMJD3 promotes the epithelial-mesenchymal transition and migration of glioma cells via the CXCL12/CXCR4 axis." Oncology Letters. October 9, 2019.
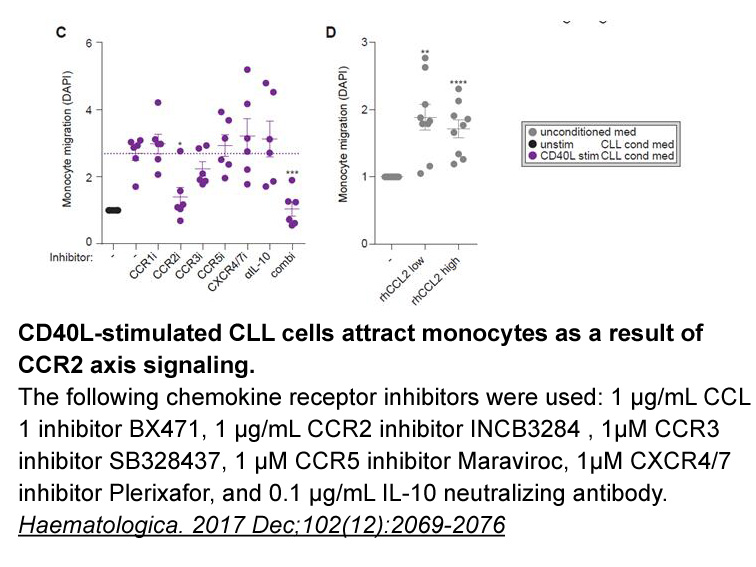
- 2. van Attekum MHA, van Bruggen JAC, et al. "CD40 signaling instructs chronic lymphocytic leukemia cells to attract monocytes via the CCR2 axis." Haematologica. 2017 Dec;102(12):2069-2076. PMID:28971904
- 3. Li P, Deng J, et al."Blockade of hypoxia-induced CXCR4 with AMD3100 inhibits production of OA-associated catabolic mediators IL-1β and MMP-13." Mol Med Rep. 2016 Aug;14(2):1475-82. PMID:27356492
| Physical Appearance | A solid |
| Storage | Store at -20°C |
| M.Wt | 502.78 |
| Cas No. | 110078-46-1 |
| Formula | C28H54N8 |
| Solubility | ≥25.14 mg/mL in EtOH; insoluble in DMSO; ≥2.9 mg/mL in H2O with gentle warming |
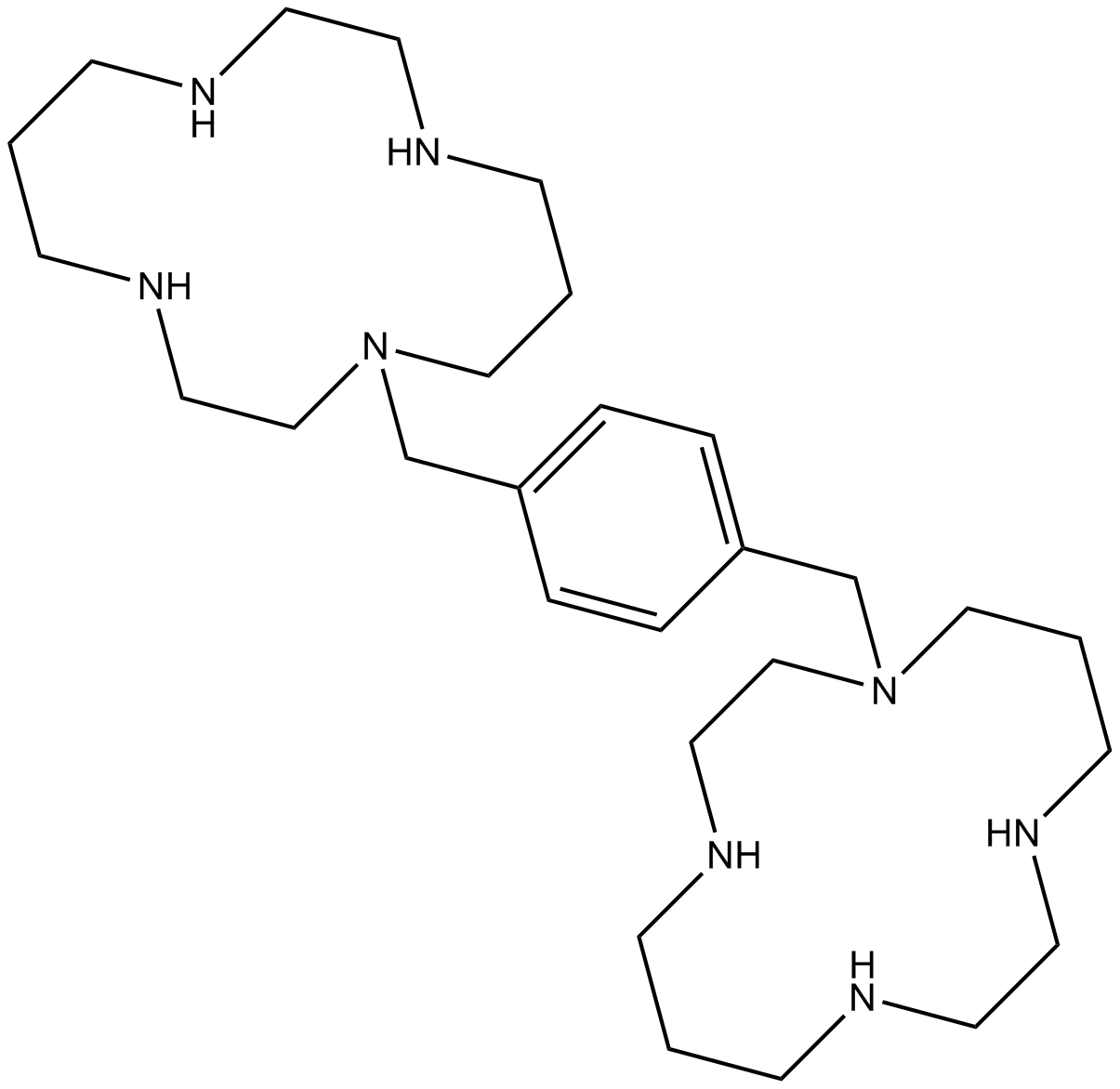
| Chemical Name | 1-[[4-(1,4,8,11-tetrazacyclotetradec-1-ylmethyl)phenyl]methyl]-1,4,8,11-tetrazacyclotetradecane |
| SDF | Download SDF |
| Canonical SMILES | C1CNCCNCCCN(CCNC1)CC2=CC=C(C=C2)CN3CCCNCCNCCCNCC3 |
| 运输条件 | 蓝冰运输或根据您的需求运输。 |
| 一般建议 | 不同厂家不同批次产品溶解度各有差异,仅做参考。若实验所需浓度过大至产品溶解极限,请添加助溶剂助溶或自行调整浓度。溶液形式一般不宜长期储存,请尽快用完。 |
| 激酶实验 [1]: | |
|
受体结合实验 |
对于CXCR4的竞争性结合研究,使用Milipore DuraporeTM滤板,将不同浓度的Plerixafor与5 × 105 CCRF-CEM细胞和100 pM 125I-SDF-1α(2200 Ci/mmol)置于结合缓冲液(PBS包含5 mM MgCl2,1 mM Ca Cl2,0.25% BSA, pH 7.4)中,4°C孵育3小时。使用冷的HEPES(50 mM)和NaCl(0.5 M,pH 7.4)洗涤除去未结合的125I-SDF-1α。BLT1的竞争性结合试验于CHO-S细胞膜(表达重组BLT1)上进行。首先进行机械性剪切破坏,随后通过高速离心分离细胞裂解液,将制备所得的细胞膜重新悬浮于含50 mm HEPES和5 mM MgCl2的缓冲液中,并将其急速冷冻。在室温下,将细胞膜与Plerixafor一起孵育1小时。上述混合物包含了50 mM Tris,10 mM MgCl2(pH 7.4),10 mM CaCl2,4 nM LTB4以及1 nM 3H-LTB4(195.0 Ci/mmol)和8 μg细胞膜。使用Millipore型GF-C过滤板将未结合的3H-LTB4过滤分离。 |
| 细胞实验 [2]: | |
|
细胞系 |
表达EGFP-CXCR4的U2OS细胞 |
|
制备方法 |
在DMSO中的溶解度受限。若配制更高浓度的溶液,一般步骤如下:请将试管置于37℃加热10分钟和/或将其置于超声波浴中震荡一段时间。原液于-20℃可放置数月。 |
|
反应条件 |
2.5 mg/mL;30分钟 |
|
试验结果 |
CXCR4和SDF-1在调节癌细胞侵袭与转移中发挥重要作用。Plerixafor有效抑制SDF-1与CXCR4结合,从而抑制癌症转移。 |
| 动物实验 [3]: | |
|
动物模型 |
节段性骨缺损的C57BL/6小鼠 |
|
给药剂量 |
5 mg/kg;腹腔注射 |
|
实验结果 |
给予同类小鼠PBS、IGF1、PDGF、SCF或VEGF,持续5天,在第5天给予Plerixafor。与PDGF,SCF和VEGF结合Plerixafor的试验组相比,同时接受了IGF1和Plerixafor的小鼠具有最高的菌落数量与大小。 |
|
其他注意事项 |
请于室内测试所有化合物的溶解度。虽然化合物的实际溶解度可能与其理论值略有不同,但仍处于实验系统误差的允许范围内。 |
|
References: [1]. Fricker SP, Anastassov V, Cox J, Darkes MC, Grujic O, Idzan SR, Labrecque J, Lau G, Mosi RM, Nelson KL, Qin L, Santucci Z, Wong RS. Characterization of the molecular pharmacology of AMD3100: a specific antagonist of the G-protein coupled chemokine receptor, CXCR4. Biochem Pharmacol. 2006 Aug 28;72(5):588-96. [2]. Li J, Oupick? D. Effect of biodegradability on CXCR4 antagonism, transfection efficacy and antimetastatic activity of polymeric Plerixafor.Biomaterials. 2014 Jul;35(21):5572-9. [3]. Kumar S, Ponnazhagan S. Mobilization of bone marrow mesenchymal stem cells in vivo augments bone healing in a mouse model of segmental bone defect. Bone. 2012 Apr;50(4):1012-8. |
|
质量控制和MSDS
- 批次:
化学结构

相关生物数据
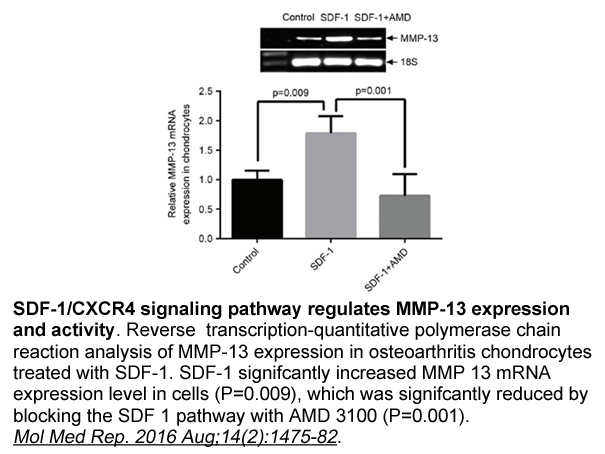
相关生物数据